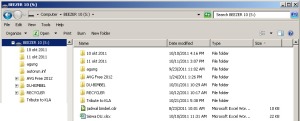
- dihidden adalah gambar icon-icon foldernya tampak pudar (
 ). Untuk mengembalikannya dengan cepat caranya adalah :
). Untuk mengembalikannya dengan cepat caranya adalah : - Masuk ke command prompt, dengan cara klik “Start – All Programs – Accesories – Command Prompt”
 atau dari menu “RUN”, ketik cmd dan tekan OK/Enter.
atau dari menu “RUN”, ketik cmd dan tekan OK/Enter.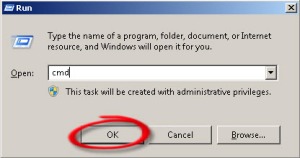
- Karena pada contoh ini flashdisk terdeteksi sebagai drive S, maka pada command prompt, pindahkan dahulu drive yang aktif ke drive S, caranya ketikkan S: (ketik S diikuti dengan titik dua).
Catatan : untuk drive-nya silahkan disesuaikan dengan nama Drive FlashDisk yang terdeteksi di komputer anda masing-masing (bisa D, E, F, G, H, dll). - Langkah selanjutnya adalah ketikkan: ATTRIB /?
Perintah ATTRIB (Attribute) adalah perintah DOS yang berfungsi untuk mengubah attribut2 dari files atau folders. Untuk melihat Opsi-opsinya silahkan ketik : ATTRIB /?
Untuk kedua langkah diatas, perhatikan gambar berikut ini :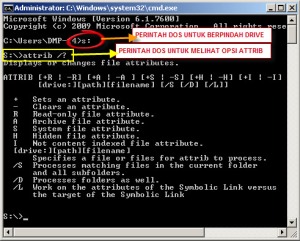
- Selanjutnya Ketikkan perintah: ATTRIB -R -A -S -H /S /D lalu tekan ENTER
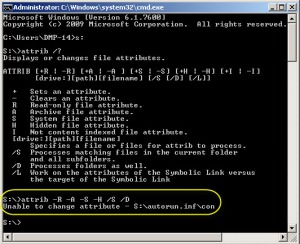
- Gambar diatas adalah hasil dari perintah (ATTRIB -R -A -S -H /S /D), perhatikan pada bagian yang dilingkari warna kuning bahwa ada folder yang tidak bisa diubah attributnya, yaitu folder (s:\autorun.inf\con). Sebenarnya folder ini adalah folder bawaan/back-up dari si VIRUS, biasanya tidak bisa didelete langsung dan salah satu cara yang efektif adalah menggunakan “Unlocker“, caranya :
- Klik kanan pada folder “\autorun.inf”, kemudian klik “Unlocker”
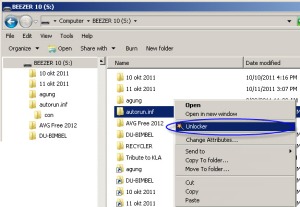
- Pada menu dropdown di Unlocker, pilih Delete lalu klik OK

- Berikut keterangan bahwa folder “\autorun.inf” sudah berhasil didelete.
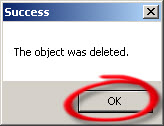
- Untuk memastikan, pada command prompt, ketikkan lagi perintah: ATTRIB -R -A -S -H /S /D lalu tekan ENTER

- OK sekarang “everything is OK”, proses mengembalikkan folder-folder yang disembunyikan sudah berhasil dilakukan.
- ketik "dir/a"
- Masuk ke command prompt, dengan cara klik “Start – All Programs – Accesories – Command Prompt”
- Kembali ke Windows Explorer, coba sekarang anda perhatikan lagi isi di dalam flashdisk-nya :

- Coba bandingkan gambar pada langkah No.7 dengan gambar pada langkah No.5 diatas. Icon-icon folder di gambar langkah No.7 tampak sudah jelas (tidak buram seperti icon-icon folder di gambar langkah no.5). Selanjutnya adalah tinggal mendelete shortcut-shortcut dan file-file yang tidak
- diperlukan. Ini contoh hasil akhirnya
maybe, you can see that.. please. :)
Rabu, 21 November 2012
Selasa, 06 November 2012
korosi

BAB 1
PENDAHULUAN
1.1. Latar
Belakang
Proses
pengaratan umumnya terjadi pada benda-benda yang terbuat dari besi, seperti
pagar, jembatan, badan kendaraan bermotor, dan kaleng kemasan. Karat yang
terjadi pada benda-benda tersebut, terjadi karena cat atau lapisan lain yang
melapisi bodi besi tersebut terkelupas sehingga bagian besinya menjadi terbuka.
Selanjutnya, besi tersebut akan bereaksi dengan udara dan uap air hujan dan
membentuk karat. Karat ini tampak sebagai lapisan berwarna cokelat kekuningan
di permukaan logam besi.
Karat
merupakan hasil dari korosi, yaitu oksidasi suatu logam. Besi yang mengalami
korosi membentuk karat dengan rumus Fe2O3..
xH2O. Korosi atau proses pengaratan merupakan proses
elektrokimia. Pada proses pengaratan,(Fe) bertindak sebagai reduktor dan
oksigen(O2) yang terlarut dalam air bertindak sebagai oksidator.
Persamaan
Reaksi pembentukan karat adalah sebagai berikut;
Anode : Fe(s) ↔ Fe2+(aq) + 2e Eº
= +0.44 V
Katode : O2(g) + 4H+(aq)
+ 4e ↔ 2H2O(l) Eº = +1.23 V
Karat
yang terjadi pada suatu logam akan mempercepat proses pengaratan berikutnya.
Oleh karena itu, karat disebut juga sebagai autokatalis. Mekanisme reaksi
oksidasi besi yang terpapar di udara dan mengalami kontak dengan air adalah
sebagai berikut; logam besi yang letaknya lebih di dalam dan jauh dari
permukaan kontak dengan udara akan dioksidasi menjadi ion Fe2+ yang
larut dala air (H2O). Tempat terjadinya reaksi oksidasi di salah
satu tetesan ujung air (H2O) ini di sebut anode. Kation yang
terbentuk bergerak dari anode ke katode melalui tetesan air, sedangkan elektron
yang mengalir dari anode ke katode melalui logam. Elektron ini selanjutnya
bereaksi dengan oksigen dari udara sehingga oksigen tereduksi menghasilkan air.
Ujung tetesan air tempat terjadinya reaksi reduksi ini disebut katode. Sebagian
oksigen dari udara larut ke dalam tetesan air dan mengoksidasi Fe2+
menjadi Fe3+ yang membentuk karat besi, Fe2O3.
H2O.
1.2.
Tujuan
·
Mengetahui paku pada botol keberapa yang pertamakali
berkarat.
·
Mengatahui paku pada botol keberapa yang tidak berkarat.
·
Mengetahui paku pada botol keberapa yang memilki paling
banyak karat
·
Menyebutkan urutan paku yang berkarat.
·
Mengetahui faktor-faktor yang mempengaruhi karat pada
paku
1.3. Manfaat Percobaan
Dengan
adanya hasil percobaan ini, diharapkan dapat menambah wawasan dan pengetahuan bagi siswa-siswi SMA Neg 02
Sungguminasa dalam ilmu sains kimia, dapat menunjang siswa-siswi untuk membantu
siswa-siswi dalam menjawab soal ujian jikan nantinya materi ini masuk dalam
ujian semester 1 dan 2, serta ujian nasional.
BAB II
LANDASAN TEORI
2.1. Defenisi Korosi
2.2. Proses Terjadinya Korosi
Anode : Fe⎯⎯>Fe2+ + 2 e–
Katode : O2 +
2 H2O + 4 e– 4 OH–
Fe2+ yang dihasilkan, berangsur-angsur akan
dioksidasi membentuk Fe3+.
Sedangkan OH– akan bergabung dengan elektrolit yang ada di alam
atau
dengan ion H+ dari terlarutnya oksida asam (SO2, NO2) dari hasil
perubahan
dengan air hujan. Dari hasil reaksi di atas akan dihasilkan
karat dengan rumus
senyawa Fe2O3·xH2O. Karat ini bersifat katalis untuk
proses perkaratan
berikutnya
yang disebut autokatalis. (bse_Teguh
Pangajuanto dan Tri Hamidi,
2008)
2.3. Faktor-Faktor Penyebab Korosi
Faktor yang berpengaruh terhadap korosi dapat dibedakan
menjadi dua, yaitu yang berasal dari bahan itu sendiri dan dari lingkungan.
Faktor dari bahan meliputi kemurnian bahan, struktur bahan, bentuk kristal,
unsur-unsur kelumit yang ada dalam bahan, teknik pencampuran bahan dan
sebagainya. Faktor dari lingkungan meliputi tingkat pencemaran udara, air, suhu, kelembaban, keberadaan zat-zat kimia yang bersifat
korosif dan sebagainya.
Oksigen terlarut ( DO =
Dissolved oxygen ) → DO berperan dalam sebagian proses korosi, bila konsentrasi
DO naik, maka kecepatan korosi akan naik.
Zat padat terlarut jumlah ( TDS = total
dissolved solid ) → konsentrasi TDS sangatlah penting, karena air yang
mengandung TDS merupakan penghantar arus listrik yang baik dibandingkan dengan
air tanpa TDS. Aliran listrik diperlukan untuk terjadinya korosi pada pipa
logam, oleh karena itu jika TDS naik, maka kecepatan korosi akan naik.
pH dan Alkalinitas → mempengaruhi
kecepatan reaksi, pada umumnya pH dan alkalinitas naik, kecepatan korosi akan
naik.
Temperatur → makin tinggi temperatur,
reaksi kimia lebih cepat terjadi dan naiknya temperatur air pada umumnya
menambah kecepatan korosi.
Tipe logam yang digunakan untuk pipa
dan perlengkapan pipa → logam yang mudah memberikan elektron atau yang mudah
teroksidasi, akan mudah terkorosi
Kelembaban→ adanya uap dalam ruang yang terdapat logam
dan besi maka, dapat menyebabkan reaksdi redoks sehingga besi dan logam akan
berkarat dalam waktu yang relatif lama
Aliran listrik → Aliran listrik yang
diakibatkan oleh korosi sangat lemah dan isolasi dapat menghalangi aliran
listrik antara logam-logam yang berbeda, sehingga korosi galvanis dapat dihindari.
Bilamana aliran listrik yang kuat melewati logam yang mudah terkorosi, maka
akan menimbulkan aliran nyasar dari sistem pemasangan listrik di pelanggan yang
tidak menggunakan aarde, hal ini menyebabkan korosi cepat terjadi.
Kontaminasi zat yang bersifat korosif dan B a k t e r i → tipe bakteri tertentu
dapat mempercepat korosi, karena mereka akan menghasilkan karbon dioksida (CO2)
dan hidrogen sulfida (H2S), serta zat korosif seperti HCL. Zat-zat ini dapat menaikkan kecepatan korosi. Jika terjadi
korosi logam besi maka hal ini dapat mendorong untuk berkarat. (UPNV, 2007)
2.4. Cara Pencegahan Korosi
2.5. Sifat Kapas
Kapas memiliki sifat
menerap, artinya kapas dapat menyerap zat cair.(nestituagnes).
2.6. Kerugian Korosi
Besi atau logam yang berkarat menjadi bersifat rapuh,
mudah larut dan bercampur dengan logam lain serta bersifat racun. Air yang
mengandung besi atau logam yang mudah berkarat akan menyebabkan air menjadi
tercemar, kotor, dan beracun. Besi yang digunakan sebagai pondasi atau
penyangga jembatan, jika beskarat akan mudah ambruk. Alat-alat produksi dalam
industri makanan, farmasi, dan kimia tidak boleh menggunakan logam yang mudah
mengalami korosi, karena karat yang terbentuk akan mudah larut sehingga berbahaya
jika bercampur dengan makanan, obat-obatan, atau senyawa kimia yang diproduksi.
BAB III
METODELOGI PERCOBAAN
3.1. Alat dan
Bahan
Ø
6 Buah Paku
Ø
Amplas (Kertas Gosok)
Ø
6 Buah Botol “You C1000”
Ø
Kristal Garam(Garam kasar)
Ø Kapas
Ø Air tawar(air biasa)
Ø Air yang telah di
didihkan(air matang)
Ø Minyak tanah
3.2. Prosedur Kerja
Ø
Sediakan 6 buah botol”YouC1000”, tandai dengan botol I,
botol II, botol III, botol IV, botol V dan botol VI
Ø
Amplas seluruh paku.
Ø
Pada botol I, tuangkan air tawar pada botol (cukup
setengah botol saja), lalu masukkan 1 buah paku yang telah di amplas
sebelumnya. Biarkan botol dalam keadaan terbuka.
Ø
Pada botol II, tuangkan air matang hingga penuh dan
masukkan 1 buah paku yang telah di amplas sebelumnya. Tutup dengan rapat botol
tersebut, jangan sampai ada gelembung/ ruang udara pada botol tersebut.
Ø
Pada botol III, tuangkan kristal garam sampai permukaan
dasar botol tertutup, masukkan kapas di atas kristal garam, lalu letakkan paku
di atas kapas, jangan sampai paku tersentuh garam. Tutup rapat botol tersebut.
Ø
Pada botol IV, masukkan paku ke dalam botol, tuangkan
minyak tanah pada botol sampai paku terendam sepenuhnya oleh minyak tanah.
Ø
Pada botol V, masukkan paku kedalam botol, dan tutup
botol dengan rapat.
Ø
Pada botol VI, masukkan kristal garam pada botol hingga
permukaan dasar botol tertutupi, dan masukkan paku kedalam botol. Jangan sampai
paku tenggelam dalam kristal garam.
3.3. Hasil Pengamatan
 Hari ke- Hari ke-
Botol ke-
|
I
|
II
|
III
|
IV
|
V
|
VI
|
|
1
|
ü
|
-
|
-
|
-
|
-
|
-
|
|
2
|
ü
|
-
|
-
|
-
|
-
|
-
|
|
3
|
ü
|
ü
|
-
|
-
|
-
|
ü
|
|
4
|
ü
|
ü
|
-
|
-
|
-
|
ü
|
|
5
|
ü
|
ü
|
-
|
-
|
ü
|
ü
|
|
6
|
ü
|
ü
|
-
|
-
|
ü
|
ü
|
|
7
|
ü
|
ü
|
-
|
-
|
ü
|
ü
|
BAB IV
PEMBAHASAN
Berdasarkan hasil
percobaan dan pengamatan yang telah dilaksanakan selama satu minggu lamanya,
kami mendapati bahwa; paku akan berkarat pada botol yang berisi air, udara, dan
kristal garam seperti pada paku yang terdapat di dalam botol I,II, V, dan VI.
Mengapa? Seperti yang telah dijelaskan bahwa korosi atau proses pengkaratan
sangat di pengaruhi oleh tekanan air dan udara serta kontaminasi zat yang dapat
mempercepat terjadinya korosi. Apabila tekanan air dan udara tinggi, maka laju
korosipun akan semakin cepat sehingga paku cepat berkarat.
Seperti yang di terangkan oleh Ari Harnanto dan Ruminten
bahwa “Jika besi bersinggungan dengan oksigen atau
bersinggungan dengan logam lain dalam
lingkungan air akan terjadi
sel elektrokimia di mana logam yang memiliki E°red lebih cepat sebagai anode dan E°red
yang lebih besar sebagai
katode. Logam atau unsur yang berfungsi sebagai
anode, karena mengalami reaksi oksidasi, berarti
yang mengalami korosi”. Begitu
pula yang terjadi terhadap paku pada botol I dan II adanya singgungan antara
paku, oksigen dan air menyebabkan terjadinya reaksi redoks dan paku bertindak
sebagai anode mengalami reaksi oksidasi sehingga paku tersebut berkarat.
Pada botol ke-V, seperti yang diterangkan
oleh mahasiswa UPNV dalam penelitiannya,
salah satu faktor yang
menyebabkan suatu besi atau logam berkarat adalah Kelembaban, yaitu adanya uap dalam ruang yang terdapat logam dan besi maka,
dapat menyebabkan reaksi redoks sehingga besi dan logam akan berkarat dalam
waktu yang relatif lama. botol yang kami gunakan adalah botol yang belum
sepenuhnya kering(lembab) akibat proses pemberasihan dan pengeringan yang
sangat cepat sehingga paku tersebut berkarat akibat adanya sentuhan oleh
permukaan botol kaca yang bersifat lembab(sedikit mengandung uap air) sehingga
paku tersebut berkarat dalam waktu yang cukup lama.
Dan pada paku botol ke-VI, paku tersebut bersentuhan
dengan zat yang bersifat korosif (kristal garam) sehingga mempercepat korosi
atau pengkaratan pada paku tersebut. Dalam penelitiannya UPNV menerangkan
bahwa, adanya kontaminasi antara zat yang bersifat korosif seperti HCL dapat
mendorong besi atau logam berkarat. Begitutupula yang terjadi pada paku
botolke-VI.
Oleh karena itu, pada
paku botol ke- I,II, V dan VI dapat berkarat.
Sedangkan paku pada
botol ke- III dan IV tidak mengalami pengkaratan(tidak berkarat). Pada botol
ke-III(tertutup) terdapat kapas yang dapat menyerap air sehingga botol dalam
keadaan kering dan tanpa udara(dalam keadaan ruang hampa) sehingga tidak
terjadi reaksi redoks pada paku tersebut. Halimatuddahlia dalam makalahnya
mengatakan bahwa Besi yang terbenam dalam
minyak tidak akan berkarat, karena minyak mampu melindungi besi terhadap gas
oksigen dan uap air yang ada di udara, Sama halnya pada botol ke-VI, paku tersebut tidak dapat
berkarat, Hal ini terjadi karena paku yang terendam dalam minyak tanah/kerosin
yang dapat melindungi paku dari gas oksigen dan uap air yang ada di udara maka
tidak terjadi reaksi oksidasi reduksi, sehingga tidak terjadi pengkaratan.
Itulah sebabnya pada
botol ke-III dan ke-IV tidak dapat berkarat.
BAB V
PENUTUP
1. Kesimpulan.
o
Paku yang pertamakali berkarat adalah paku pada botol ke-
I, yaitu paku dengan air tawar dengan keadaan botol terbuka
o
Paku yang tidak berkarat adalah paku pada botol ke-III
dan ke-IV, yaitu paku pada botol yang berisi minyak tanah dalam keadaan terbuka
o
Paku yang memiliki paling banyak karatan adalah paku pada
botol ke-I
o
Berikut urutan paku yang berkarat.
1.
Paku pada botol ke-I
2.
Paku pada botol ke-VI
3.
Paku pada notol ke-II
4.
Paku pada botol ke-III
o
Faktor-faktor yang menyebabkan paku-paku tersebut
berkarat;
a)
Air
b)
Udara
c)
Kelembapan
2. Saran
DAFTAR PUSTAKA
-
Harnanto
Ari, Ruminten. 2009. Kimia 3,Untuk SMA/MA Kelas XII. Jakarta; pusat Perbukuan
-
Utami Budi(et..al).2009. Kimia 3 : Untuk SMA/MA Kelas XII Program Ilmu Alam. Jakarta; Pusat
Perbukuan
-
Pangajuanto Teguh,Rahmidi Tri.2009. Kimia 3 : Untuk SMA/MA kelas
XII. Jakarta; Pusat
Perbukuan
-
Sutresna
Nana.2003.Kimia untuk kelas III Semester 1.Bandung;Grafindo
Penyusun,
Kelompok
2
Langganan:
Postingan (Atom)